Artikel
Artikel >Sejarah dan Filosofi Unsur Kimia
Sejarah dan Filosofi Unsur Kimia

Sistem periodik unsur adalah salah satu konsep paling mendasar dalam kimia yang memungkinkan kita memahami sifat dan reaktivitas unsur-unsur. Konsep ini memberikan landasan yang kuat bagi perkembangan ilmu kimia dan memungkinkan para ilmuwan untuk memprediksi perilaku unsur-unsur yang belum ditemukan.
Sejarah dan Pengembangan
Sistem periodik pertama kali disusun oleh Dmitri Mendeleev pada tahun 1869. Mendeleev, seorang kimiawan Rusia, mengatur unsur-unsur berdasarkan massa atom relatif mereka dan sifat kimianya yang berulang secara periodik. Mendeleev mencatat bahwa unsur-unsur dengan sifat serupa muncul pada interval yang teratur ketika diurutkan berdasarkan massa atom.
Keberhasilan besar dari tabel periodik Mendeleev adalah kemampuannya untuk memprediksi sifat-sifat unsur yang belum ditemukan pada waktu itu. Dia meninggalkan ruang kosong dalam tabelnya untuk unsur-unsur yang dia yakini ada, tetapi belum terdeteksi. Prediksi Mendeleev terbukti sangat akurat ketika unsur-unsur seperti germanium dan gallium ditemukan beberapa tahun kemudian dengan sifat-sifat yang sangat mirip dengan prediksi Mendeleev.
Struktur dan Prinsip Dasar
Sistem periodik modern diatur berdasarkan nomor atom, yaitu jumlah proton dalam inti atom. Pengaturan ini menggantikan pengaturan berdasarkan massa atom yang digunakan oleh Mendeleev. Penggunaan nomor atom memberikan penjelasan yang lebih akurat dan konsisten tentang sifat periodik unsur-unsur.
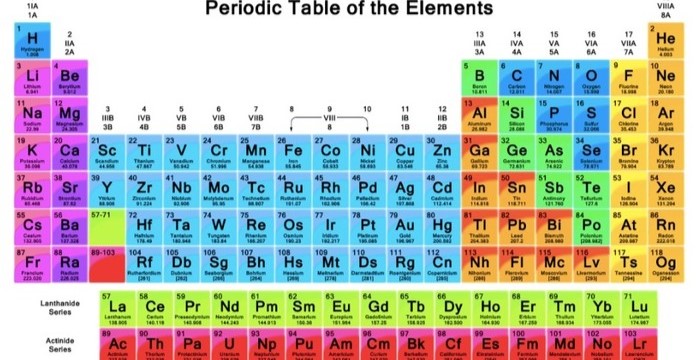 Unsur-unsur dalam tabel periodik dikelompokkan ke dalam periode (baris horizontal) dan golongan (kolom vertikal). Periode menunjukkan jumlah lapisan elektron yang dimiliki oleh atom unsur, sedangkan golongan menunjukkan jumlah elektron pada lapisan terluar (elektron valensi). Elektron valensi sangat penting karena mereka menentukan reaktivitas kimia dan sifat-sifat unsur.
Unsur-unsur dalam tabel periodik dikelompokkan ke dalam periode (baris horizontal) dan golongan (kolom vertikal). Periode menunjukkan jumlah lapisan elektron yang dimiliki oleh atom unsur, sedangkan golongan menunjukkan jumlah elektron pada lapisan terluar (elektron valensi). Elektron valensi sangat penting karena mereka menentukan reaktivitas kimia dan sifat-sifat unsur.
Sifat Periodik
Sifat-sifat unsur yang berulang secara periodik dalam tabel mencakup ukuran atom, energi ionisasi, afinitas elektron, dan elektronegativitas. Misalnya, ukuran atom cenderung berkurang dari kiri ke kanan dalam satu periode karena peningkatan muatan inti menarik elektron lebih dekat ke inti. Sebaliknya, ukuran atom meningkat dari atas ke bawah dalam satu golongan karena penambahan lapisan elektron baru.
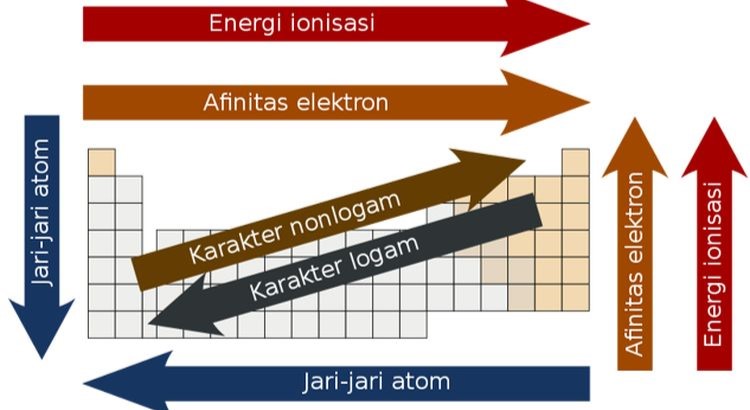 Energi ionisasi, yaitu energi yang diperlukan untuk menghilangkan satu elektron dari atom, juga menunjukkan pola periodik. Energi ionisasi cenderung meningkat dari kiri ke kanan dalam satu periode dan menurun dari atas ke bawah dalam satu golongan. Pola-pola ini membantu ilmuwan memprediksi bagaimana unsur-unsur akan berinteraksi dalam reaksi kimia.
Energi ionisasi, yaitu energi yang diperlukan untuk menghilangkan satu elektron dari atom, juga menunjukkan pola periodik. Energi ionisasi cenderung meningkat dari kiri ke kanan dalam satu periode dan menurun dari atas ke bawah dalam satu golongan. Pola-pola ini membantu ilmuwan memprediksi bagaimana unsur-unsur akan berinteraksi dalam reaksi kimia.
Pentingnya Sistem Periodik
Sistem periodik unsur adalah alat yang sangat penting dalam pendidikan kimia dan penelitian ilmiah. Dengan memahami hubungan antara unsur-unsur dalam tabel, siswa dan ilmuwan dapat mengembangkan pemahaman yang lebih dalam tentang sifat materi dan bagaimana unsur-unsur berinteraksi satu sama lain.
Perkembangan sistem periodik dari masa ke masa mencerminkan kemajuan dalam pengetahuan kita tentang struktur atom dan sifat-sifat kimia. Dari tabel sederhana Mendeleev hingga tabel periodik modern yang kita gunakan hari ini, sistem ini terus menjadi pusat dari studi kimia dan sains pada umumnya.